ב-7 באוקטובר הכריזה ועדת הפרס על הזוכים בפרס לשנת 2019. הזוכים במשותף הם ויליאם קיילין (Kaelin), סיר פיטר רטקליף (Ratcliffe) וגרג סמנזה (Semenza), על תרומתם המשותפת לחקר התאמת התאים האיקריוטיים לשינויים בזמינות החמצן.
 |
| מימין לשמאל: גרג סמנזה, סיר פיטר רטקליף וויליאם קיילין איור: Niklas Elmehed. © Nobel Media |
כל התאים האיקריוטיים (למעט חריגים בודדים) זקוקים לחמצן מולקולרי (O2) כדי להפיק בעזרתו את האנרגיה הדרושה לקיומם ולתפעולם. שלושת זוכי הפרס פענחו את המנגנון שבעזרתו חשים התאים השונים שינויים בזמינות החמצן, ומסתגלים בהתאם. לתגלית שלהם יש גם השלכות רפואיות שמאפשרות כבר היום להתמודד בעזרתן עם מספר מחלות מוכרות.
אוטו ורבורג (Warburg), שזכה בנובל הזה ב-1931, היה הראשון שהדגיש את חשיבות העניין. ב-1938 זכה גם קורניי הימנס (Heymans) בנובל על גילוי (בין היתר) הקשר של חישת ריכוז החמצן נמוך (Hypoxia) בדם והעברת האינפורמציה למוח דרך מערכת העצבים.
השלב הבא היה איתור חשיבותו של ההורמון אריתרופויטין (erythropoietin), המיוצר בכליות, שגורם לעלייה בכמות תאי הדם האדומים בזמן מחסור בחמצן. אך הגורם שמקשר בין המחסור בחמצן להורמון לא היה ידוע.
גרג סימנזה חקר את הבקרה על הגן EPO, המקודד את האריתרופויטין. הוא מצא רצפי בקרה במעלה הגן, שמפעילים את הגן בתנאי חוסר חמצן. פיטר רטקליף, שחקר את אותו גן במקביל, מצא שרצפי בקרה אלה מתבטאים ומפעילים גנים גם בתאים של רקמות רבות אחרות, שאינן מייצרות את האריתרופויטין.
סימנזה מצא, ופירסם ב-1995, את תצמיד החלבונים המתקשר לאותם רצפי בקרה שאותו כינה hypoxia-inducible factor (ובקיצור HIF). התצמיד הכיל שני חלבונים: HIF-1α ו-ARNT. אך מי מפעיל אותם כשיש מחסור בחמצן?
הסתבר שכשיש מספיק חמצן (Normoxia) החלבון HIF-1α מסומן ביוביקוויטין ומובל לפרוק בפרוטאזום. אך תהליך זה מופסק כשיורד ריכוז החמצן.
כאן נכנס לתמונה חוקר הסרטן ויליאם קיילין. שחקר את המחלה הגנטית von Hippel-Lindau’s disease (ובקיצור VHL). מחלה זו גורמת לציסטות וגידולים בתאי עור ובתאי מערכת העצבים, ולגידולים, שמתחילים כשפירים, ויש סיכוי גבוה שיהפכו לממאירים.
מחלה זו נגרמת כתוצאה ממוטציה בגן יחיד, שכונה אף הוא VHL. תפקידו המקורי של הגן VHL הוא לעכב גידולים סרטניים. קיילין גילה שבבתאי הגידולים של חולי VHL יש כמות גדולה של HIF-1α גם בנוכחות חמצן. החדרת הגן התקין לתאים החזירה את רמת ה-HIF-1α לרמה התקינה. ואז הסתבר, ש-VHL הוא חלק מהתצמיד האחראי על סימון ביוביקוויטין של HIF-1α וחלבונים אחרים. רטקליף הראה ש-VHL מגיב ישירות עם HIF-1α כחלק מהתהליך.
ב-2001 גילו קיילין ורטקליף, כל אחד בנפרד, שבנוכחות חמצן מסומן HIF-1α בשתי קבוצות הידרוקסיל על ידי אנזימים שמופעלים בנוכחות חמצן - prolyl hydroxylases - וזה מה שמאפשר ל-VHL להגיב עם HIF-1α ולסמן אותו ביוביקוויטין. רטקליף גם זיהה ואפיין את האנזימים.
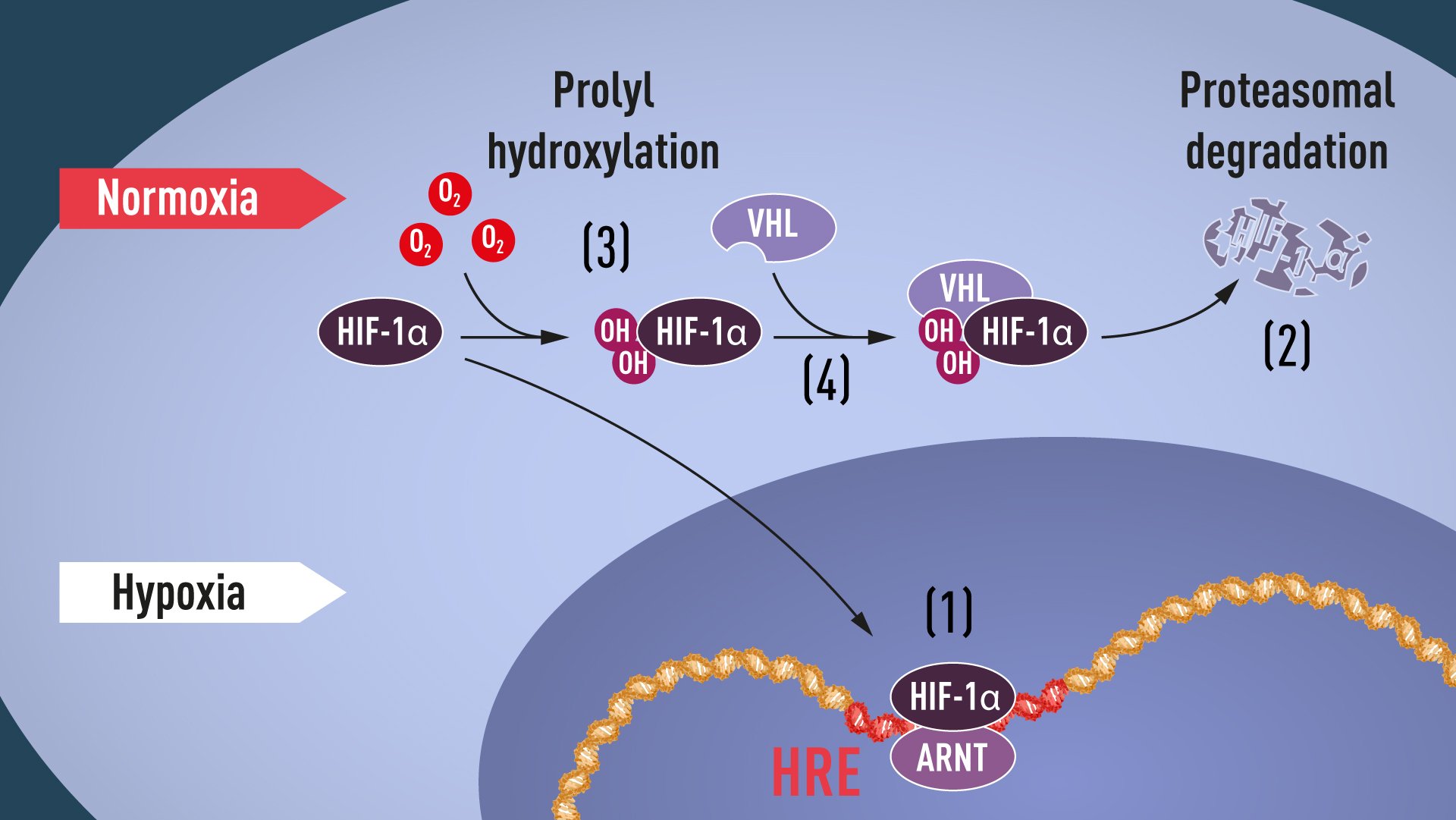 |
| תרשים הממחיש את הפעילות הביוכימית המתוארת כאן עם חמצן, למעלה, ובהעדרו, למטה. המקור - אתר הנובל |
דוגמה אחת לכך היא תרופה המעכבת את את פעילות החלבון HIF2, שלא הוזכר כאן, אך פעילות תקינה שלו דרושה להפעלת HIF-1α. התרופה, המיוצרת בחברת Eli Lilly, נמצאת במבדקים קלינים בחולי סרטן הכליה, שמחלתם נגרמת ממוטציה בגן VHL. נבדקת גם האפשרות שהתרופה תעזור גם לחולי VHL.
מחסור בחמצן קשור למחלות רבות - בעלי כשל כלייתי סובלים מאנמיה כתוצאה מהמחסור באריתרופויטין. בתאים סרטניים המחסור בחמצן גורם לתאים הסרטניים להשרות סביבם צימוח של כלי דם שמסייעים לגידול. הכרת המנגנון מסייעת לפיתוח תרופות יעודיות, חלקן כבר בצנרת.
דוגמה אחת לכך היא תרופה המעכבת את את פעילות החלבון HIF2, שלא הוזכר כאן, אך פעילות תקינה שלו דרושה להפעלת HIF-1α. התרופה, המיוצרת בחברת Eli Lilly, נמצאת במבדקים קלינים בחולי סרטן הכליה, הנובע ממוטציה בגן VHL. ויתכן שאף תעזור לחולי VHL.
מקורות ולקריאה נוספת:
הודעה לעיתונות של ועדת הפרס
מידע מפורט יותר - באתר הנובל
מאמר על התרופה שמעכבת את HIF2 - מכתב העת Journal of Clinical Oncology
כתבה על הזכייה בכתב העת Nature
פורסם במקביל גם בדף הפייסבוק של מדעי הטבע והחיים באוניברסיטה הפתוחה
הודעה לעיתונות של ועדת הפרס
מידע מפורט יותר - באתר הנובל
מאמר על התרופה שמעכבת את HIF2 - מכתב העת Journal of Clinical Oncology
כתבה על הזכייה בכתב העת Nature
פורסם במקביל גם בדף הפייסבוק של מדעי הטבע והחיים באוניברסיטה הפתוחה























מלך
השבמחקנפלא.
השבמחקמעניין מאוד!.
תודה רבה על העידכון :-)